TOPICS
コールドチェーン
CAR-T細胞療法~いまどの地点にいるのか?
CAR-T細胞療法~いまどの地点にいるのか?
CAR T-Cell Therapy:Where are We Today?
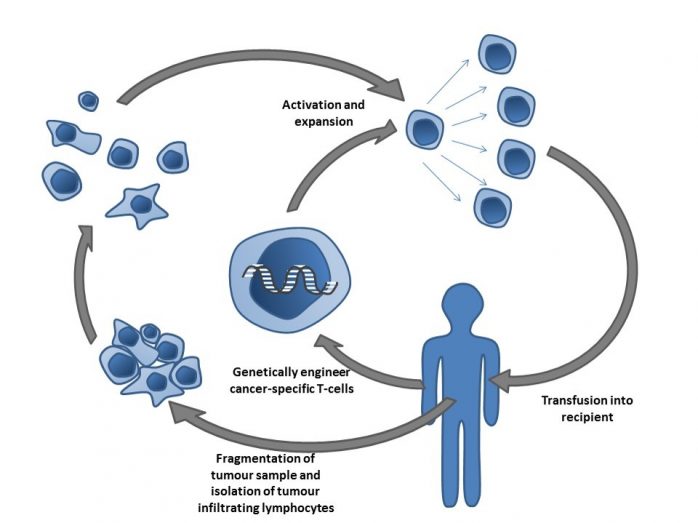
CAR-T細胞療法は、患者特有のがん細胞に特化したT細胞を産生することにより効果を発揮します。出展:Wikimedia.org
*Astero Bio社が旧medcision社の事業を承継しておりましたが、Astero Bio社がBioLife Solutions社に吸収合併されたことにより、現在はBioLife Solutions社が事業を引き継いでいます。
今、CAR-T細胞(CAR-T: Chimeric antigen receptor T cell)療法分野でどのような進歩がみられるのでしょうか、そして今後どのような期待ができるのでしょうか?名高いがん生物学者であるIsabelle Rivière博士が行ったBioInsights Webinarにおいて、こういった疑問への回答がありました。
CAR-T細胞療法は、がん治療に対して目覚ましい結果を残しています。しかし、この細胞をベースとした治療法の、研究レベルから治療レベルへの移行は、決して順調ではありませんでした。臨床試験では、重篤な副作用や死亡例がありました。これらの痛ましい事例は、この分野への大きな注意や警戒を引き起こしています。しかし、全体的には楽観視されています。CAR-T細胞試験は白血病やB細胞リンパ腫などの血液がんの治療に対して興味深い結果を示しています。例えば、ある研究では、「治療不能」である急性型白血病を患う成人および小児で、CAR-T細胞療法を受けた後、最大90%が寛解しています。CAR-T細胞製品のそれぞれの連続した段階では、治療効果を高めつつ副作用を最小限に抑えることが求められてきました。
Rivière博士は、Memorial Sloan Kettering Cancer Centerで研究を行っています。そして、細胞療法および細胞工学施設の所長という役割において、彼女は極めて多くのCAR-T臨床試験のデータを有しており、その結果として彼女はCAR-T細胞療法の基本的な問題や課題について良好な感触を得ています。
CAR-T療法のすべてで、最高レベルに重要なものが製造プラットフォームです。製造プラットフォームは最終製品へのロードマップのように機能します。最初のステップは「何をすべきか」という一般的な概要を確立することです。一旦確立してしまえば、道に沿ってそれぞれの段階で特定の手法を実施することが可能です。
CAR-T療法は患者から始まります。細胞がアフェレーシス(分離)によって採取されます。血液サンプル採集プロセスの後、血漿から細胞を分離します。通常、この段階で細胞を凍結保存し、次の段階に備えます。次の段階へ進むことが可能になると、細胞を融解・洗浄し、T細胞を細胞群から分離します。こうして分離されたT細胞を活性化し、通常は遺伝子操作を行い、適切な投与量となるまで増殖させ、保管や輸送のために凍結保存されます。そして、治療が行われる当日に細胞を融解し、患者へ投与します。
Rivière博士は、良い結果のためには、はじめに免疫細胞がどのように機能するかをしっかりと理解すべきだと強く述べています。CAR-T細胞療法の「中核となる仮説」は、患者自身のT細胞が特異的に患者のがん形態を標的にできるようにするというものです。従って、CAR-T細胞を「作る」ためには、はじめにがん細胞に特異的に発現しているマーカーを認識するよう、患者自身のT細胞を操作します。
第一世代のCAR-T療法はCD8+ T細胞に焦点をおいていましたが、第二世代、第三世代のCAR-T療法は、シグナルドメインを含むより多くのがん細胞マーカーを標的とするT細胞が含まれており、より多くのT細胞の機能を発揮します。Rivière博士の研究室では、第三世代の「CD19標的」CAR-T細胞についての研究を行っています。これらの細胞は一般的には、初期の臨床試験に使用された細胞よりも高い活性や増殖能を持つように操作されます。第一相臨床試験では急性白血病の治療に焦点を置いており、CD19標的CAR-T細胞による治療を行った患者の77-90%が完全寛解に至りました。この特異的なCAR-T医薬品は、FDAから「ブレイクスルー療法」として特別に指名されています。これは、臨床試験を進行したまま承認プロセスを早めるということです。
活性や増殖能の増強でCAR-T療法の効果を改善できる一方で、その他の改善の可能性についても試験が行われています。がん細胞は免疫系から「隠れる」方法を有しており、研究者らはこれを克服するためのT細胞の能力を増強する方法について取り組むととともに、CAR-T細胞の選択、標的、生存、増殖能の改善についても取り組んでいます。
例として、Rivière博士の研究室では、最近、組み換え用遺伝子のT細胞への導入効率を高める方法について研究を行っていました。これを実行するための効果的な方法は、CD14細胞特有の細胞分子を消去することであり、これは磁気ビーズを使用することで可能です。Rivière博士のグループは、従来のダイナビーズではなくバイオ技術企業であるミルテニー社の新しいTransACTビーズを使用することで、遺伝子導入効率を高めることを可能としました。
彼女の研究室はまた、増殖時のCAR-T細胞を良好に保つ上で、どの成長因子や栄養物質が最適かについても探索を行っています。それぞれの小さなステップが重要であり、最終製品の全体的な効果を向上する方法は多く存在します。
製造プラットフォームの最適化は、細胞の最適化と同等に重要です。
Rivière博士は統合・自動化されたプラットフォームが、細胞製品の製造において高品質や製品の一貫性を実現するために重要であると強く確信しています。彼女の研究室はミルテニー社のCliniMACS Prodigyシステムを利用しています。この装置は、製造において必須である様々なステップを1つの装置内に内蔵していることから、細胞療法分野においては人気のある製品です。Rivière博士の研究チームは新鮮な状態のものと、凍結保存状態のアフェレーシス産物から分離されたT細胞を使用しており、そのどちらにおいても同程度に高品質(90-97%)な結果が得られることを確認しています。最初の細胞の回復は新鮮なアフェレーシス産物の方が幾分高いものの、いずれにおいても細胞生存率は高い(80%以上)こと、そしてProdigyシステムを利用して、一般的な患者への投与量と同等量の細胞量を容易に到達できることを確認しています。
Rivière博士は自動化製造プラットフォームと、一般的な自動化手法を強く提唱しています。彼女は製造およびその下流の細胞療法プロセスにおける自動化の利点を列挙しています。その利点とは、より良好なプロセスコントロール、高スループット、製品の一貫性、そして再現性です。我々は、様々な細胞療法プロセスを自動化する多様な方法や、細胞療法が承認、製品化される際にこれらの手法がどのようにしてコストダウンに役立つかについて議論してきました。
自動化のラストマイルプロセス、すなわち薬剤の配送や投与は、ここで特筆するに値します。なぜなら、これらの活動は実際の製造プロセスとは別のものであり、かつ、製造のプロセスと同じくらい重要なものだからです。病院やクリニックのようなポイントオブケア施設は、最終的にCAR-T細胞療法のような治療を、製品を損なうことなく患者に投与する責任があります。これには、一貫性や再現性のある効果を保証する方法で細胞を確実に融解することも含まれます。これについては、旧medcision社のThawSTAR凍結細胞自動融解ステーションのような自動融解システムの使用を推奨します。
Rivière博士は、近い将来CD19 CAR-T細胞が承認され、同様の製品の承認が広がるだろうと予測しています。彼女の研究チームは白血病のような血液がんの治療に焦点を置いているものの、彼女はCAR-T細胞の固形がんへの適用についてもさらに研究したいと考えており、CAR-T細胞療法の分野は拡大し、成長していくと予想しています。
- 参考文献:
- 1. Riviere I. The Latest Developments in CAR T- cell Manufacturing. Online webinar series. Cell and Gene Therapy Insights. Aril, 2017. 2. Norkus M., et al.
PDFファイルはこちらからダウンロードできます。
記事一覧はこちら

