TOPICS
アプリケーションノート
Application Note:Celloger® Mini Plusを用いた有糸分裂観察
1.はじめに
細胞周期の過程で、細胞は遺伝的に同じ2つの娘細胞に分裂します。この過程は、細胞の恒常性を維持するために細胞分裂やDNA複製をコントロールする複数の複雑なシグナル経路によって制御されています1。一方で、がん細胞は細胞周期の制御が効かない状態で増殖、分裂します。このがん細胞の異常増殖を抑えるために、有糸分裂阻害剤が使用されます2。特に、ノコダゾールは有糸分裂阻害剤の代表的な薬剤として知られており、細胞質や核分裂の際の微小管の動きを阻害するという特徴を有しています3,4。
この実験では、細胞分裂プロセスをモニタリングし、がん細胞株に対するノコダゾールの有糸分裂阻害効果を試験しました。このため、細胞周期における染色体構造の動きを視覚化できるよう、緑色蛍光タンパク(GFP)を融合したヒストン2B(H2B-GFP)をHeLa細胞にトランスフェクトしました5。その後、細胞に対してノコダゾール処理を行い、ライブセルイメージングシステムである、Celloger® Mini Plusを用いて細胞分裂をモニタリングしました。
2.方法
H2B-GFPプラスミドでトランスフェクトしたHeLa細胞を、4×104cells/ウェルの濃度で24ウェルプレートに播種しました。細胞は、300μg/mLの濃度でG418を添加したDMEM培地(10%FBS)で培養を行いました。細胞を接着させるため、オーバーナイトで培養した後、一部のウェルに62.5nMノコダゾールを添加し、Celloger® Mini Plus(明視野、緑色蛍光チャネル、10×)を用いてリアルタイムイメージングを行いました。画像は15分おきに撮影し、24時間モニタリングを行いました。
3.結果
細胞の有糸分裂の核の変化を観察するため、緑色蛍光タンパクを融合したH2BをトランスフェクトしたHeLa細胞について、明視野および蛍光タイムラプスイメージングを実施しました。明視野画像においては、はじめ核膜が明瞭に観察され、次にそれが徐々に消失し、染色体が細胞の中心に整列する中期の様子が明視野および蛍光画像で観察されました(図1A)。このとき、染色体は凝縮し、それ以前と比べて蛍光強度が強くなりました。その後、染色体は2つの娘染色体に分裂し、2つの紡錘体の方へそれぞれ移動していきました。最後の画像に見られるように、終期には2つの娘細胞が生じました。一方で、ノコダゾール処理を行った細胞では、染色分体が両側へ分かれることができず、細胞分裂周期は進行しませんでした。
明視野画像では、細胞がプレートに接着しなくなる様子が見られ、また蛍光画像からは、アポトーシスの結果、最終的にDNAが断片化したことが確認されました(図 1B)。
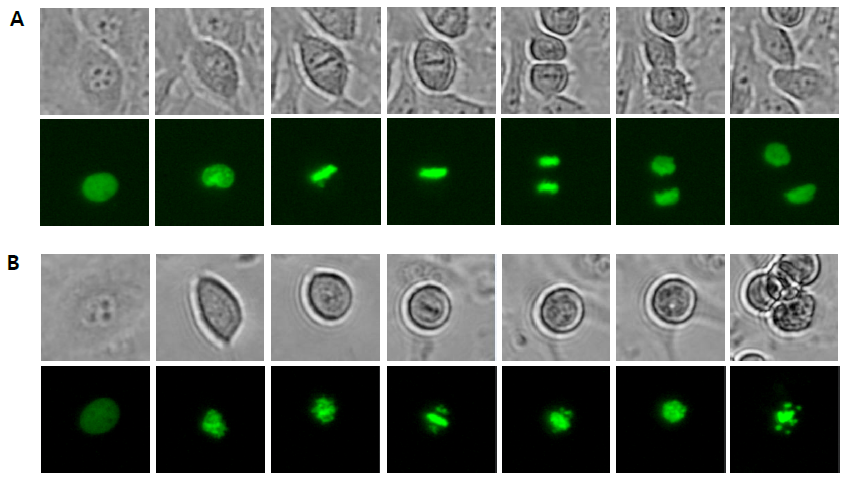
A、Bともに、上の画像が明視野、下の画像が蛍光画像。画像の切り取りや補正にはImageJソフトウェアを使用した。
- ノコダゾール未処理の細胞(コントロール)
- 62.5nM ノコダゾール処理した細胞。
4.結論
生細胞の細胞内小器官(オルガネラ)の動きを観察する上で、蛍光標識は有効なツールです。これまでに、蛍光標識したタンパクを用いた、多様な細胞内小器官観察や標的タンパクを観察するためのプラスミドが開発されており、様々な刺激によるタンパクのトランスロケーションや細胞内小器官の変化を検証するための研究が多く行われてきました。
このアプリケーションノートでは、DNAに結合するヒストン/緑色蛍光融合タンパクを使用し核のラベリングを行いました。細胞分裂におけるノコダゾールの効果を確認するため、細胞を一定時間にわたってモニタリングし、リアルタイムライブセルイメージャー、Celloger® Mini Plusを使用して画像を撮影しました。この装置にはモーター駆動のカメラが内蔵されており、ユーザーの設定に合わせた様々な位置や間隔で撮影を行うことができます。これにより、様々な条件下における各細胞の変化を追跡することが可能となります。
5.参考文献
- Mills, Christopher C., E. A. Kolb, and Valerie B. Sampson. "Development of Chemotherapy with Cell-Cycle Inhibitors for Adult and Pediatric Cancer Therapy Combination Therapies for Cancer." Cancer research 78.2 (2018): 320-325.
- Otto, Tobias, and Piotr Sicinski. "Cell cycle proteins as promising targets in cancer therapy." Nature Reviews Cancer 17.2 (2017): 93-115.
- Blagosklonny, Mikhail V. "The power of chemotherapeutic engineering: arresting cell cycle and suppressing senescence to protect from mitotic inhibitors." Cell cycle 10.14 (2011): 2295-2298.4. Taciak, Bartłomiej, et al. (2018) PloS one
- Endo, Kingo, et al. "Nocodazole induces mitotic cell death with apoptotic-like features in Saccharomyces cerevisiae." FEBS letters 584.11 (2010): 2387-2392.
- Anda, Teru, Kevin F. Sullivan, and Geoffrey M. Wahl. "Histone–GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells." Current Biology 8.7 (1998): 377-385.
翻訳・文責:ワケンビーテック株式会社 企画推進部
本資料はワケンビーテック株式会社がCuriosis社の許諾を得て日本語訳したものです。Curiosis社および当社の許諾なく複製、転載を行うことはお控えください。

