TOPICS
アプリケーションノート
Application Note:免疫学的研究における浮遊細胞の安定的イメージングのためのCO2インキュベーター内据付型ライブセルイメージングシステム
マクロファージ細胞株における形態学的変化および食作用活動観察に対するCelloger Mini Plusの使用
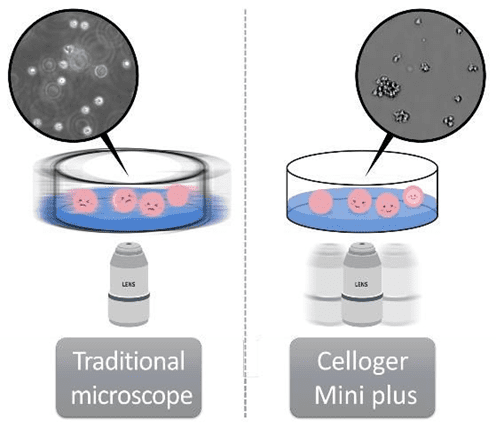
免疫機能を担う白血球細胞は血管内を流れる浮遊細胞であり、免疫学の研究においては、白血球に由来する様々な浮遊細胞が用いられます。浮遊細胞は接着細胞と異なり、顕微鏡にプレートを載せるというわずかな動きでも細胞が浮いてしまいます。温度やCO2の安定性が原因となる問題のほかに、浮遊細胞をリアルタイムにモニタリングする上で、従来の顕微鏡を使用することができないという問題があります。従って、浮遊細胞の安定的なモニタリングには、Celloger®のようなインキュベーター内で操作することが可能なライブセルイメージングシステムが必要となります1。また、Celloger® Mini Plusは、ステージが動かず、内蔵カメラが動くことにより、プレートを動かさず細胞が安定した状態で複数ポジションでの撮影が可能です。浮遊細胞をCelloger®と顕微鏡で観察した場合、Celloger®で撮影した画像の方が顕微鏡と比較してより鮮明な画像が得られました。顕微鏡で得られた画像では、ピントが合わず不鮮明な細胞が見られました(図1参照)。
白血球は、免疫系細胞として感染と戦い、外部の異物から身体を守ります。自然免疫として知られている防御系の最初のラインは、病原体が体中に広がるのを防ぐため、速やかに炎症反応を引き起こします。自然免疫の反応は数時間以内に開始し、急速な炎症反応を引き起こしますが、この過程で発生する様々な細胞防御反応をリアルタイムで観察することが重要です。自然免疫の重要な役割は、感染エリアに免疫細胞を速やかに動員することです。白血球のうち、単球は組織に浸入し、マクロファージへ分化する一方で、食作用により、病原体に対する免疫反応を引き起こします。私たちは、マクロファージの特性を有する細胞で、リポポリサッカライド(LPS)によって変化が引きこされることが知られている細胞株、Raw264.7を用い、Celloger® Mini Plus(明視野&緑色蛍光、10×対物レンズ)でライブセルイメージングを行いました。2
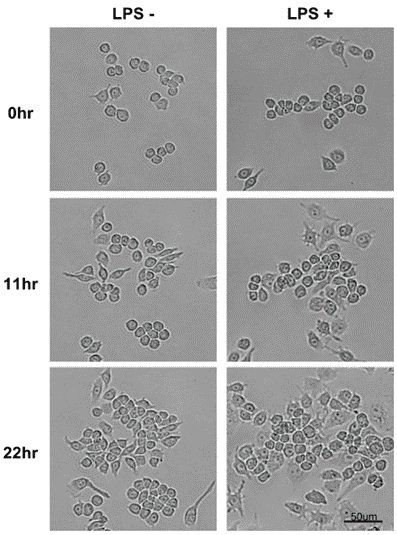
Raw264.7をLPSで刺激すると、分化した細胞が増加しました。ゆるく接着していた円形の細胞や厚い立方体状の細胞が分化するにつれ、ゆっくりと広がり、紡錘形になってより強く接着する様子が見られました。
この結果は、Celloger® Mini Plus(10×)を使用し、15分おきに画像を撮影することで得られました。
Saxenaらの研究(2003)によると、Raw264.7細胞はLPSによる刺激で樹状様細胞へ分化するとされています。Celloger® Mini Plusを用いたリアルタイムモニタリングを利用し、LPS刺激の無い場合に比べて、細胞がより強く接着し、より扁平に広がっていくことを確認しました。
この形態の変化は、LPS刺激から11時間後により鮮明となり、最長22時間程度継続しました。また、LPSの刺激によって細胞が増殖しましたが、これをCelloger®のコンフルエンシー解析機能を用いて定量化しました。
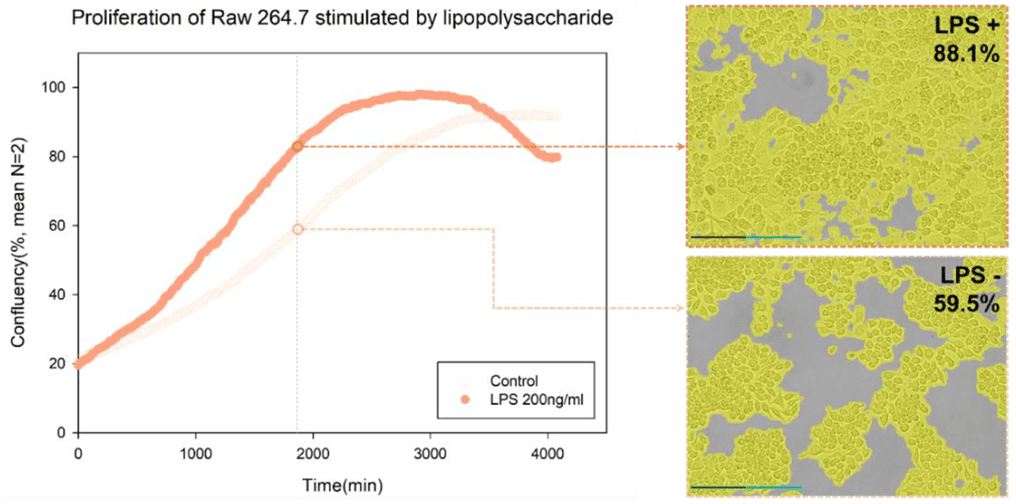
Celloger® Mini Plus(10×)で撮影したタイムラプス画像を、Celloger® Mini Plus analysis appを用いてコンフルエンシー解析機能により定量化しました。
LPS誘導によるマクロファージの活性化が、Toll様受容体4(TLR4)依存経路を介して食作用を増強するという報告があります2,4。リアルタイムでこの内容を確認するため、マクロファージの食作用によって取り込まれる蛍光ラテックスビーズを使用し、蛍光イメージングを行いました。2μmの蛍光ビーズはわずかな動きで簡単に揺れ動き、またプレート内で浮遊していました。これは、細胞の食作用による取り込み効率を下げるだけでなく、イメージング自体を難しくします。実際に、市販の食作用アッセイキットでは、取り込まれなかったビーズを取り除くため、アッセイのエンドポイントで適切な洗浄を行ってから、ビーズを取り込んだ細胞のみを蛍光顕微鏡かフローサイトメトリーでカウントするよう推奨しています。本実験では、Celloger®のリアルタイムイメージングにより、細胞によるビーズに対する食作用全体の様子と、ビーズの取り込みが、LPS刺激により扁平に広がった、活性化された細胞でのみ起こることが示されました。(図4A)
活性化細胞の動きは、予測可能であると考えられます。というのも、円形や立方体の分化前細胞と比較し、活性化細胞は方向性のある紡錘状になることで効率的にビーズへ移動するためです。また、細胞がビーズを取り込んだ後に、細胞質とともにビーズが娘細胞に分割する様子がリアルタイムで観察されました。(図4B)
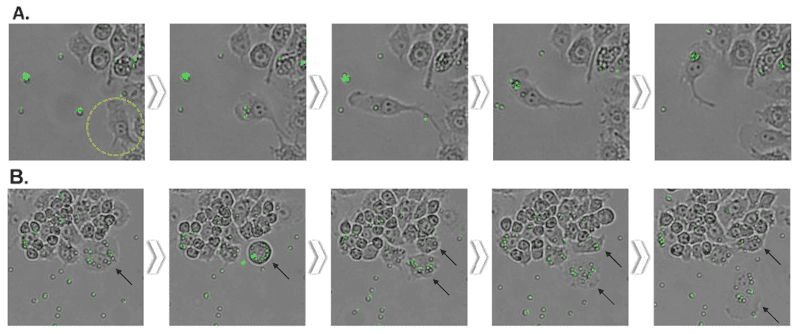
- LPS刺激後に、活性化Raw264.7細胞が蛍光ビーズを取り込む様子が見られた。15分間隔でタイムラプス撮影を行い、細胞がビーズに向かって移動し、ビーズを取り込む様子を観察した。
- 細胞内に取り込まれたビーズは、有糸分裂の際に細胞質とともに娘細胞へ分割された。
加えて、蛍光プローブのユニークな特性を利用することで、様々な分子環境に対する動的情報を取得することができます。明視野画像に蛍光画像をマージできれば、さらに深い研究を行うことができます。細胞膜非透過性核酸染色色素を使用すれば、アポトーシスの際に起こる膜障害による色素透過性の増加を通じて、細胞毒性を評価することができます7。また、特に好中球の場合は、核酸染色を行うことでNETs(好中球細胞外トラップ)の形成を検出することができます8。さらに、活性酸素種と反応する色素を使用することで細胞内の活性酸素の発生を定量化したり9、pH感受性色素を使用することで、飲食作用(エンドサイトーシス)や食作用(ファゴサイトーシス )の過程で起こる細胞内酸性化を観察することができます10。
Celloger® Mini Plusを使用したライブセルイメージングでは、細胞ダメージやブレなどの物理的な問題を防ぎながら、高解像度の画像を取得することが可能です。この製品はインキュベーター内で完璧に機能する自動システムのため、インキュベーターに出し入れする必要はありません。他の装置と違い、Celloger® Mini Plusには可動性のステージがありません。その代わり、内蔵の可動式カメラによって複数ポジションの画像を取得することが可能です。容器や細胞が動かないため、環境が安定しており、細胞をベースとした研究の成功率を高めます。様々なタイプの培養容器に対応しており、高い位置再現性により、マルチポイントイメージングにおいて安定したスキャニングを行うことが可能です。
このように、Celloger® Mini Plusは免疫研究において、信頼性のある結果をもたらします。
参考文献
- Awasthi, Bhuwan Prasad, et al. (2021) Journal of Enzyme Inhibition and Medicinal Chemistry
- Wu, Tsu Tuan et al. (2009) Toxicology letters vol.
- Saxena, Rajiv K et al. (2003) Journal of biosciences vol.
- Taciak, Bartłomiej, et al. (2018) PloS one
- Ariganello, Marianne B., et al. (2018) International journal of nanomedicine
- MandaManda‐Handzlik, Aneta , et al. (2018) Immunology and Cell Biology
- Riss, Terry, et al. (2019) Assay Guidance Manual
- Takishita, Yutaka, et al. (2019) Journal of Clinical Biochemistry and Nutrition
- Pal, Kunal, et al. (2019) Materials Science and Engineering: C
- Diwu, Zhenjun, et al. (1999) Chemistry & biology
翻訳・文責:ワケンビーテック株式会社 企画推進部
本資料はワケンビーテック株式会社がCuriosis社の許諾を得て日本語訳したものです。Curiosis社および弊社の許諾なく複製、転載を行うことはお控えください。

